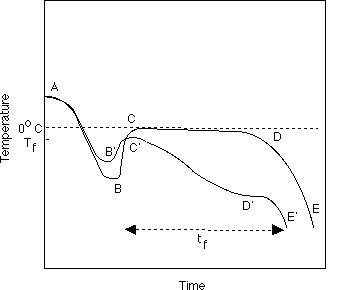
Uma vez que a massa crítica de núcleos é alcançada, o sistema se nucleia no ponto B ou B' na figura e lança seu calor latente mais rapidamente que calor que está sendo removido do sistema. Em soluções aquosas, porém, B' não é tão baixo quanto B, desde que o soluto somado promova uma nucleação heterogênea, e assim acelerare o processo de nucleação. A temperatura aumenta imediatamente até a temperatura de congelamento inicial, Tf, da solução no ponto C ou C'. A presença de solutos resulta em depressões do ponto de congelamento, baseado na Lei de Raoult que relaciona pressão de vapor da solução com a concentração de soluto. Note que C' não é tão alto quanto C, porque o ponto de congelamento inicial está deprimido como resultado do soluto. Conseqüentemente, o soluto grandemente diminuiu a quantidade de subresfriamento por duas razões: nucleação mais rápida e ponto de congelamento abaixado. Em soluções muito concentradas, é difícil se induzir o subresfriamento.
Em água pura, a linha de tempo de C para D na figura reflete o tempo durante o qual crescimento de cristal está acontecendo. Rápidas taxas de congelamento promovem a formação de muitos cristais de gelo pequenos durante este período. A mistura parcialmente congelada não esfriará até que toda água "cristalizavel" se cristalize; conseqüentemente, a linha C D acontece a temperatura quase constante. O tempo de congelamento, tf, é definido como o tempo do inicio de nucleação, C, até a remoção completa do calor latente, D. Depois da cristalização completa, a temperatura cai de D a E com o lançamento de calor sensível.
Durante o processo de congelamento da solução, acontece primeiramente a formação de cristáis de gelo puros, (C'D'). Isto faz cair a temperatura de congelamento para a solução restante. A temperaturas bem debaixo do ponto de congelamento inicial, permanecem ainda alguns restos de água líquidos. Também, um aumento grande na viscosidade da fase de descongelada acontece, diminuindo as propriedades de difusão do sistema assim dificultando a cristalização. em D', um do solutos pode se tornar supersaturado e pode lançar seu calor latente de cristalização, podendo causar um salto leve em temperatura de D' para E'. Estes pontos são conhecidos como pontos euteticos. De E' para F',ocorre uma cristalização continuada de solvente, e possivelmente do soluto, acontece, até que o sistema é completamente cristalizado ou solidificado, a muito baixas temperaturas. É mais difícil de dizer o tempo de congelamento neste processo, mas normalmente é levado como o tempo para alcançar alguns predeterminadas temperaturas debaixo do ponto de congelamento inicial.
Formação da Fase Vítrea em Comidas Congeladas
Durante o congelar de comidas, é formado gelo na forma de água pura por dois-passos (nucleação e propagação) do processo de cristalização. Como, com diminuições de temperatura, é removida a água de uma comida na forma de gelo, os solutos apresentam no UFP são congelados concentrados. Um equilíbrio de temperatura de congelamento existe para cada relação de gelo/UFP que é função da concentração de soluto. Este processo de equílibrio termodinâmico pode ser modelado em um diagrama de fase como sendo uma curva de equilíbrio que gela (liquidos) (veja figura abaixo) que estende-se da temperatura de fusão (Tm) de água pura (0oC) para a temperatura eutetica (Te) do soluto, o ponto ao qual o soluto se congela na concentração de saturação.
Como a temperatura é abaixada, é altamente improvável que soluto se cristalize na Te, devido a viscosidade alta de concentração de soluto, e a baixa temperatura, de forma que a concentração para o congelamento se dá além de Te em um estado de não-equilíbrio. Um UFP altamente concentrado pode passar então por uma transição de estado de liquido/vidro, dirigida pela redução do movimento molecular e difusão cinéticas como resultado da concentração muito alta e baixa temperatura.
Um vidro é definido como um não-equilíbrio, metaestavel, sólido amorfo, desordenado de viscosidade extremamente alta (ie., 10 exp10 a 10 exp14 Pa.s), também sendo uma função de temperatura e concentração. A curva de transição de vidro estende da temperatura de transição de vidro (Tg) de pura água (-134oC) para o Tg de puro soluto. O diagrama de fase de equilíbrio e o diagrama de estado cinetico podem ser junto modelados em um diagrama suplementar de estado. O diagrama de estado adicional mostra os limites de coexistência de solido/liquido e o perfil de transição de vidro para um sistema de açucar/água binário é mostrado na figura abaixo. Debaixo e à direita da linha de transição vítrea, a solução está no estado de vidro amorfo, com ou sem presença de gelo que depende de temperatura e caminho de congelamento seguido, enquanto que acima e à esquerda da linha de transição vítrea, a solução está no estado líquido, com ou sem gelo que depende de temperatura.
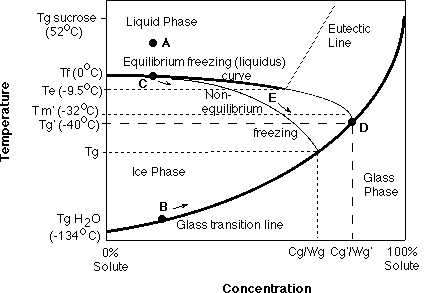
Como um exemplo, assuma uma solução de sacarose com uma concentração inicial de 20% a temperatura ambiente (ponto A). A Tg inicial desta solução a temperatura ambiente antes da separação de fase está marcado como ponto B (se a solução pudesse ser subresfriada a esta temperatura sem formação de gelo). Porém, ao esfriar um pouco lentamente o sistema debaixo de seu equilíbrio do ponto de congelamento (devido ao subresfriamento), nucleção e cristalização subseqüente começa no ponto C e inicia o processo de congelar, removendo a água em sua forma pura, como gelo. Como a cristalização do gelo procede, o aumento ininterrupto em concentração de soluto (remoção de água) mais adiante deprime o equilíbrio até certo ponto do UFP que segue a curva liquidos (mostrado como caminho C) enquanto o Tg do UFP promove a linha de transição de vidro (caminho B; devido a concentração aumentada) com um aumento rápido em viscosidade de uma maneira de não-Arrhenius, particularmente em recentes fases do processo gelado.
Co-cristalização de soluto ao Te é improvável e assim a temp. de congelar continua Te passando de um estado de não-equilíbrio, desde que o soluto se torna supersaturado. Quando uma concentração crítica, soluto-dependente é alcançada, o líquido não congelado mostra uma mobilidade muito resistida e o estado físico do UFP muda de um líquido viscoelastico para um vidro sólido frágil, amorfo.
A interseção da extensão de não-equilíbrio da curva liquidos, além de Te, e a determinada curva de transição de vidro, ponto D na acima de figura, representa o soluto específico, no máximo, se gela na concentraram Tg do sistema congelado, Tg' denotado onde cessa a formação de gelo dentro do tempo medido. As concentrações máximas correspondem a água e sacarose dentro do vidro a Tg' e impossibilitada de cristalizar. e é denotado o Wg' e Cg', respectivamente. Vale notar que esta água descongelada não é enquadrada em uma " sensação enérgica ", bastante impossibilitada de gelar dentro de intervalos de tempo práticos.
Em Tg', o solute supersaturado não assume propriedades sólidas por causa do movimento molecular reduzido que é responsável pela tremenda redução em rotational translational,e sua mobilidade. É esta lentidão intrínseca de reorganização molecular debaixo de Tg' que o tecnólogo de comida busca criar dentro da fase se concentrada componentes circunvizinhos de materiais de comida.
Porém, esquentando do estado vítreo a temperaturas sobre os resultados de Tg' em um tremendo aumento em difusão, não só dos efeitos do amorfo a transição líquida viscosa mas também de diluição aumentada como derretendo de cristais de gelo pequenos acontece quase simultaneamente (Tg' = Tm'). A tempo de reestruturação molecular continuamente se aproxima de mudanças como em Tg, de forma que tecnólogos de comida também podem ganhar alguns aumentos de estabilidade a temperaturas sobre Tg' minimizando o delta T entre a temperatura de armazenamento e Tg', ou por temperaturas de armazenamento reduzidas ou formulação. Conseqüentemente, o conhecimento da transição vítrea provê uma indicação clara de difusão molecular e reatividade, e então a estabilidade.